- Wikisun
HSAB nəzəriyyəsi
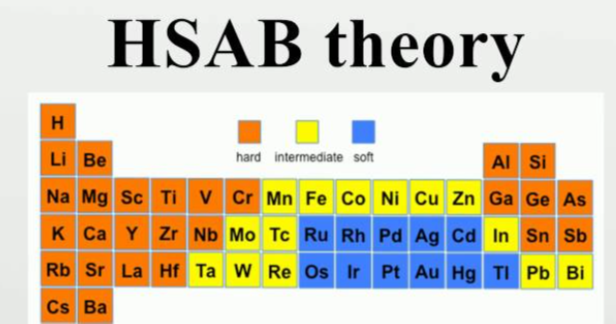
HSAB nəzəriyyəsi - Kimyəvi reaksiyaların baş vermə şəraitini proqnozlaşdırmaq və izah etmək məqsədilə asid və baza qarşılıqlı əlaqələrini sərt və yumşaq kateqoriyalarına bölən nəzəriyyə. Mahiyyəti Bu nəzəriyyə, asidlər və bazalar arasındakı qarşılıqlı əlaqələri onların sərtlik və ya yumşaqlıq xüsusiyyətlərinə əsaslanaraq izah edir. HSAB nəzəriyyəsi kimya sahəsində əhəmiyyətli yer tutur və xüsusilə koordinasiya kimyasında, katalizdə və metal ionlarının reaktivliyinin təhlilində geniş istifadə olunur. Tarix HSAB nəzəriyyəsi 1963-cü ildə Ralph G. Pearson tərəfindən təklif edilmişdir və onun əsas məqsədi, asid və baza qarşılıqlı əlaqələrinin xüsusiyyətlərini sərtlik və yumşaqlıq baxımından təsnif etməkdir. Bu nəzəriyyəyə görə, sərt asidlər sərt bazalarla, yumşaq asidlər isə yumşaq bazalarla daha güclü və davamlı əlaqələr qururlar. Hər iki komponentin sərtlik və yumşaqlığı onların elektron strukturuna, ölçüsünə, yüklənməsinə və digər kimyəvi xüsusiyyətlərinə bağlıdır. Asid və baza sərtliyi - Sərt asidlər (Hard Acids): Kiçik ölçülü və yüksək yüklü ionlardır. Bu ionlar ümumiyyətlə elektron sıxlığını yaxşı saxlayır və bu səbəbdən sabitdirlər. Məsələn, H+, Al3+, Fe3+ kimi ionlar sərt asidlərə misaldır. - Yumşaq asidlər (Soft Acids): Böyük ölçülü, az yüklü və elektron sıxlığı daha az olan ionlardır. Bunlar daha asanlıqla elektron paylaşırlar və zəif bağlar formalaşdırırlar. Cu+, Ag+, Hg2+ kimi ionlar yumşaq asidlərə nümunədir. - Sərt bazalar (Hard Bases): Kiçik ölçülü, yüksək yüklü və sabit ionlardır. Bu bazalar, sərt asidlər kimi, elektron sıxlığını qoruyur və bu səbəbdən daha az reaktivdirlər. Məsələn, OH-, F-, Cl- kimi ionlar sərt bazalardır. - Yumşaq bazalar (Soft Bases): Böyük ölçülü və az yüklü ionlar və molekullar olan yumşaq bazalar, sərt bazalara nisbətən daha çox elektron paylaşırlar. Məsələn, I-, S2-, PH3 kimi ionlar yumşaq bazalardır. Əsas prinsip HSAB nəzəriyyəsi, asidlər və bazalar arasındakı qarşılıqlı əlaqələrin güclü və zəif tərəflərini müəyyən edərək kimyəvi reaksiyaların yönünü müəyyən edir. - Sərt asidlər və sərt bazalar: Sərt asidlər və sərt bazalar daha güclü və stabillik tələb edən reaksiyalar yaradırlar. Bu cütlər arasında qarşılıqlı əlaqə, yüksək enerjili bağlar və çox davamlı komplekslər formalaşdırır. - Yumşaq asidlər və yumşaq bazalar: Yumşaq asidlər və yumşaq bazalar arasında qarşılıqlı əlaqələr daha zəif, lakin çevik və dəyişkən olur. Yumşaq bazalar daha asan elektron verə bilirlər, buna görə də bu cütlər arasında bağlar daha az enerjili olur. HSAB nəzəriyyəsi çox geniş tətbiq sahələrinə malik olsa da, bəzi məhdudiyyətlərə də sahibdir. Bəzi hallarda nəzəriyyənin tətbiqi, real kimyəvi reaksiyalarda gözlənilən nəticələri verməyə bilər. Məsələn, bəzi asid-baza reaksiyaları, HSAB nəzəriyyəsi solventin təsiri və molekulyar strukturların dəyişməsi kimi amillər səbəbilə, proqnozlaşdırılandan fərqli şəkildə inkişaf edə bilər.
İstinadlar
https://en.wikipedia.org/wiki/HSAB_theory
https://www.degruyter.com/document/doi/10.1351/pac199466051077/html
https://pubs.acs.org/doi/abs/10.1021/ja00905a001
https://www.ias.ac.in/chemsci/Pdf-sep2005/369.pdf
https://books.google.az/books?id=MxZhcgIg9x0C&redir_esc=y
https://chem.libretexts.org/Courses/Saint_Marys_College_Notre_Dame_IN/CHEM_342%3A_Bio-inorganic_Chemistry/Readings/Week_3%3A_Metal-Ligand_Interactions_continued..../3.2%3A_The_identity_of_metal_ion_and_the_ligand_donor_atom(s)_affects_affinity/3.2.1%3A_Hard_and_Soft_Acid_and_Base_Theory
http://www.adichemistry.com/inorganic/cochem/hsab/hard-soft-acid-base-theory.html
https://www.khanacademy.org/test-prep/mcat/physical-sciences-practice/x04f6bc56:foundation-5-chemical-processes/e/applications-of-hard-soft-acid-base-theory
chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.shahucollegelatur.org.in/Department/Studymaterial/sci/chem/hs.pdf
https://www.aakash.ac.in/important-concepts/chemistry/hsab-principle
https://pmc.ncbi.nlm.nih.gov/articles/PMC3288258/
Tarix : 22 yanvar 2025
Əksi qeyd olunmayıbsa, bu məzmun CC BY-SA 4.0 çərçivəsində yayımlanır.

